■ Les entités chimiques qui composent un système sont microscopiques, il peut s'agir d'atomes, d'ions ou de molécules. Les compter une par une est une tâche techniquement presque irréalisable et qui prendrait une durée énorme. Au lieu de compter les entités une par une, le chimiste les compte par lots, par paquets bien définis. Un tel paquet de chimiste est appelé une mole et chaque paquet contient toujours le même nombre d'entités chimiques. Ce nombre vaut 6,022 × 1023 entités.
La masse des atomes de chaque élément chimique (hydrogène, carbone, oxygène, etc.) est très bien connue après mesures au laboratoire. Il est donc facile de connaître la masse d'une mole d'atomes d'hydrogène, ou de carbone, par exemple. La quantité de matière d'une entité ou d'une espèce chimique présente dans un échantillon désigne le nombre de moles que cet échantillon compte pour cette entité ou cette espèce chimique.
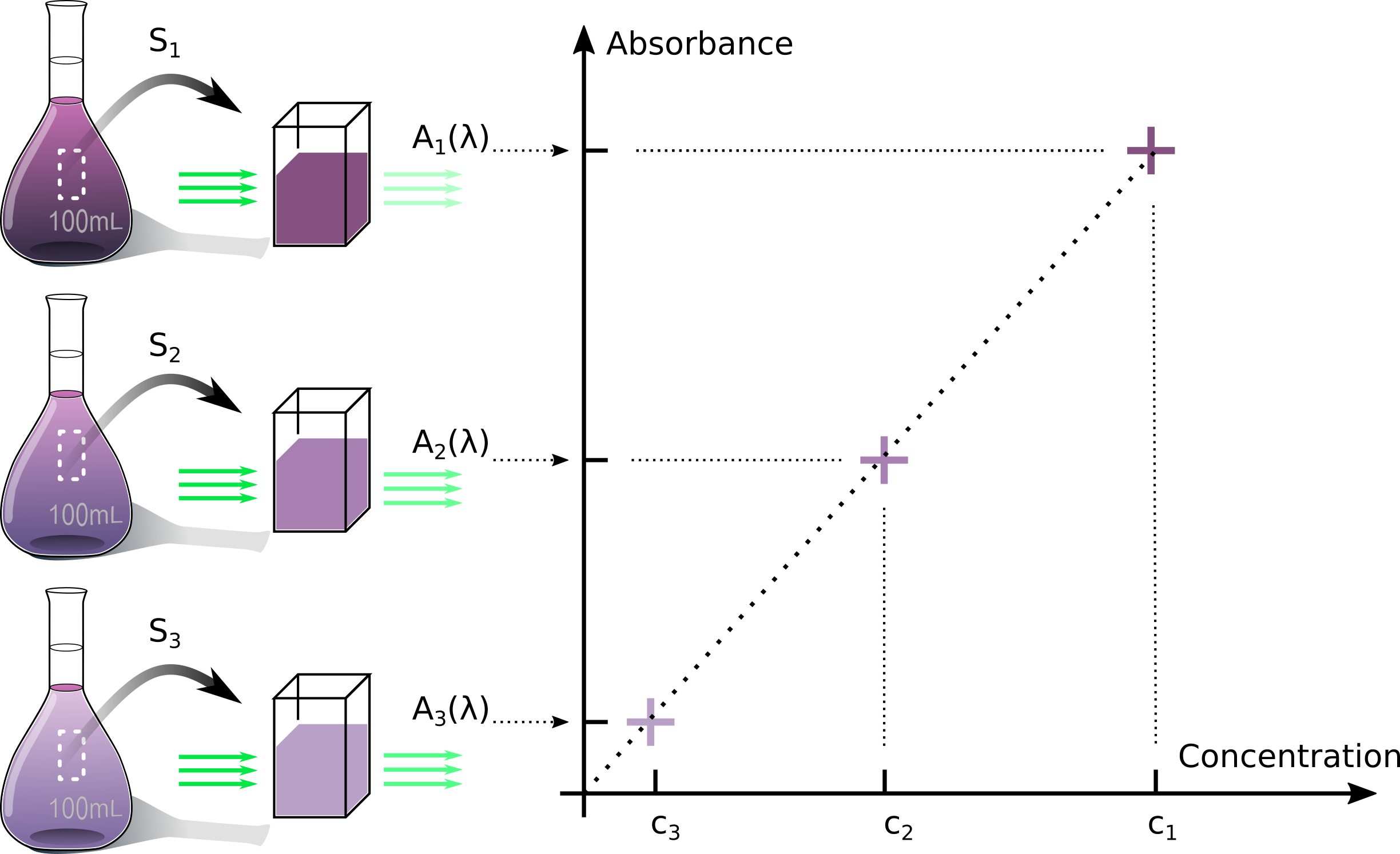
■ Lorsqu'un soluté est placé dans l'eau et qu'il s'y dissout, le mélange obtenu est une solution aqueuse. La teneur en soluté dans la solution
est quantifiée par la concentration en masse de soluté : c'est la masse de soluté par unité de volume de la solution.
■ La lumière peut être decomposée, à l'aide d'un prisme ou d'un spectromètre, en ses différentes radiations constitutives. La lumière blanche est caractérisée par un spectre continu, c'est-à-dire que sa décomposition produit un bandeau lumineux coloré de bout en bout et dont les couleurs s'étendent du violet au rouge. À chaque nuance de couleur est associée une longueur d'onde notée λ. La longueur d'onde du violet vaut 400 nm (1 nm = 1 nanomètre = 1 milliardième de mètre = 1×10-9 m).